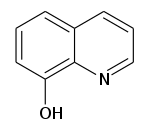
8-Гідроксихінолін
| 8-Гідроксихінолін | |
|---|---|
| |
| |
| Назва за IUPAC | Хінолін-8-ол, 8-Хінолінол |
| Інші назви | 1-азанафтелен-8-ол, Феннозан H 30, гідроксибенопіридин, оксихінолін, фенопіридин, хінофенол, оксин |
| Властивості | |
| Молекулярна формула | C9H7NO |
| Молярна маса | 145.16 г/моль |
| Зовнішній вигляд | Білі голчасті кристали |
| Густина | 1.034 г/см3 |
| Тпл | 72-74°C |
| Небезпеки | |
| ГГС формулювання небезпек | H301: Отруйно при ковтанні
H317: Може викликати алергічну реакцію шкіри H318: Викликає серйозні пошкодження очей H360D: Може шкодити плоду в утробі матері H400: Дуже отруйно для водяних організмів H410: Дуже отруйно для водяних організмів, із тривалими наслідками [1] |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
8-Гідроксихінолін (також відомий як оксин) — це хелатуючий агент, який використовується для кількісного визначення іонів металів.
У водному розчині 8-гідроксихінолін має pKa значення 9.9.[2] Він реагує з іонами металів, втрачаючи при цьому протон і утворюючи 8-гідроксихінолінатні-хелатні комплекси. Добре дослідженим є комлекс з алюмінієм — тріс(8-гідроксихінолінат)алюмінію відомий також як Alq3.
Alq3[3] є поширеним компонентом органічних світлодіодів (OLED). Заміна замісників на хінолінових кільцях ліганду впливає на його люмінесцентні властивості.[4]
У фотохімічно-індукованому збудженому стані утворє цвіттеріонні ізомери, в яких атом водню переміщується з атому оксигену на нітроген.[5]
Комплекси 8-гідроксихіноліну, як власне і сама сполука, проявляють антисептичні, дезінфікуючі та пестицидні властивості.[6][7][8] Його розчин у спирті використовують у «рідких пов'язках».[9] 8-гідроксихінолін та його похідні представляють інтерес як протиракові препарат.[10][11][12]
Відомий тіоловий аналог 8-гідроксихіноліну, 8-меркаптохінолін.[13]
Коріння інвазивної рослини Centaurea diffusa виділяє 8-гідроксихінолін, що негативно впливає на місцеві рослини, що не є пристосованими до цього так як вони не мали спільного еволюційного минулого.[14]

- ↑ 8-Hydroxyquinoline Health Hazards. PubChem. Архів оригіналу за 20 вересня 2020. Процитовано 25.09.2020.
- ↑ Albert, A.; Phillips, J. N. (1956). 264. Ionization Constants of Heterocyclic Substances. Part II. Hydroxy-Derivatives of Nitrogenous Six-Membered Ring-Compounds. Journal of the Chemical Society (Resumed). 1956: 1294—1304. doi:10.1039/JR9560001294.
- ↑ Katakura, R.; Koide, Y. (2006). Configuration-Specific Synthesis of the Facial and Meridional Isomers of Tris(8-hydroxyquinolinate)aluminum (Alq3). Inorganic Chemistry. 45 (15): 5730—5732. doi:10.1021/ic060594s. PMID 16841973.
- ↑ Montes, V. A.; Pohl, R.; Shinar, J.; Anzenbacher, P. Jr. (2006). Effective Manipulation of the Electronic Effects and Its Influence on the Emission of 5-Substituted Tris(8-quinolinolate) Aluminum(III) Complexes. Chemistry: A European Journal. 12 (17): 4523—4535. doi:10.1002/chem.200501403. PMID 16619313.
- ↑ Bardez, E.; Devol, I.; Larrey, B.; Valeur, B. (1997). Excited-State Processes in 8-Hydroxyquinoline: Photoinduced Tautomerization and Solvation Effects. The Journal of Physical Chemistry B. 101 (39): 7786—7793. doi:10.1021/jp971293u.
- ↑ Phillips, J. P. (1956). The Reactions of 8-Quinolinol. Chemical Reviews. 56 (2): 271—297. doi:10.1021/cr50008a003.
- ↑ 8-Hydroxyquinoline. Medical Dictionary Online. Архів оригіналу за 9 жовтня 2016. Процитовано 9 березня 2016.
- ↑ Srisung, S.; Suksrichav, T.; Prachayasi, S.; Ruchirawat, S.; Prachayasi, V. (1 лютого 2013). Antimicrobial Activity of 8-Hydroxyquinoline and Transition Metal Complexes. International Journal of Pharmacology. Т. 9, № 2. с. 170—175. doi:10.3923/ijp.2013.170.175. Архів оригіналу за 7 грудня 2021. Процитовано 25 вересня 2020.
- ↑ New-Skin Liquid Bandage Original, 1 oz (англ.) . Процитовано 25.09.2020.
- ↑ Shen, A. Y.; Wu, S. N.; Chiu, C. T. (1999). Synthesis and Cytotoxicity Evaluation of some 8-Hydroxyquinoline Derivatives. Journal of Pharmacy and Pharmacology. 51 (5): 543—548. doi:10.1211/0022357991772826. PMID 10411213.
- ↑ Shah, Purvi; Abadi, Leila F.; Gaikwad, Shraddha; Chaudhari, Dasharath; Kushwah, Varun; Jain, Sanyog; Bhutani, Kamlesh K.; Kulkarni, Smita; Singh, Inder P. (17 жовтня 2018). Synthesis and Biological Evaluation of 8-Hydroxyquinoline-hydrazones for Anti-HIV-1 and Anticancer Potential. ChemistrySelect. Т. 3, № 38. с. 10727—10731. doi:10.1002/slct.201802283. ISSN 2365-6549. Процитовано 25 вересня 2020.
- ↑ Jiang, Hongchao; Taggart, Jori E.; Zhang, Xiaoxi; Benbrook, Doris M.; Lind, Stuart E.; Ding, Wei-Qun (2011-12). Nitroxoline (8-hydroxy-5-nitroquinoline) is more a potent anti-cancer agent than clioquinol (5-chloro-7-iodo-8-quinoline). Cancer Letters (англ.). Т. 312, № 1. с. 11—17. doi:10.1016/j.canlet.2011.06.032. PMC 3395224. PMID 21899946. Архів оригіналу за 7 грудня 2021. Процитовано 25 вересня 2020.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Fleischer, Holger «Structural chemistry of complexes of (n — 1)d10nsm metal ions with β-N-donor substituted thiolate ligands (m=0, 2)» Coordination Chemistry Reviews 2005, volume 249, pp. 799—827. DOI:10.1016/j.ccr.2004.08.024
- ↑ Vivanco, J.M.; Bais, H.P.; Stermitz, F.R.; Thelen, G.C.; Callaway, R.M. (2004). Biogeographical variation in community response to root allelochemistry: novel weapons and exotic invasion. Ecology Letters. 7 (4): 285—292. doi:10.1111/j.1461-0248.2004.00576.x.
- ↑ Cölle, M.; Dinnebier, R. E.; Brütting, W. (2002). The structure of the blue luminescent δ-phase of tris(8-hydroxyquinoline)aluminium(III) (Alq3). Chemical Communications. 2002 (23): 2908—9. doi:10.1039/b209164j. PMID 12478807.