Полярність (хімія)
Поля́рність — властивість, що характеризує розділення зарядів (неспівпадання центрів позитивного та негативного зарядів) у молекулах, їхніх фрагментах чи окремих зв'язках та зумовлює їхній дипольний момент. Виникає через різну електронегативність складових атомів. Термін застосовується як до окремих молекулярних частинок так і до речовин. Більш полярними є молекули з йонними зв'язками, молекули з ковалентними зв'язками є менш полярними. У випадку однакових атомів або груп утворені зв'язки між ними є неполярними, тобто їх дипольний момент є нульовим. Кількісною характеристикою полярності молекулярних частинок є їх дипольний момент, полярності середовища — діелектрична стала.
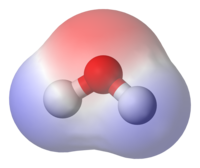
Полярні речовини хімічно активні і при розчиненні у воді дисоціюють на йони. До полярних речовин належать неорганічні кислоти і їхні солі, вода та ряд природних мінералів. Тверді полярні речовини гідрофільні. На противагу цьому, аполярними є сполуки, в молекулах яких електричні центри позитивних і негативних зарядів збігаються, тому кінці молекул електронейтральні. До аполярних речовин відноситься багато органічних рідин з симетричною будовою молекул (наприклад, насичені вуглеводні) і тверді речовини з насиченими ковалентними зв'язками. Аполярні речовини у воді не розчинюються, хімічно малоактивні і гідрофобні.
Сполуки, молекули яких складаються з полярних і неполярних груп атомів, називаються гетерополярними. Вони володіють одночасно властивостями полярних і неполярних сполук. Полярні кінці молекул гідрофільні і змочуються водою, а неполярні — гідрофобні і не змочуються водою. До гетерополярних речовин належить багато флотаційних реагентів. У флотаційної пульпі гетерополярні речовини адсорбуються на межі розділу фаз і створюють точно орієнтований шар. Орієнтація молекул залежить від полярності фаз: аполярний кінець гетерополярної молекули завжди спрямований у бік менш полярної фази.
- Глосарій термінів з хімії / уклад. Й. Опейда, О. Швайка ; Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Дон. : Вебер, 2008. — 738 с. — ISBN 978-966-335-206-0.
- Мала гірнича енциклопедія : у 3 т. / за ред. В. С. Білецького. — Д. : Донбас, 2007. — Т. 2 : Л — Р. — 670 с. — ISBN 57740-0828-2.
- Смирнов В. О., Сергєєв П. В., Білецький В. С. Технологія збагачення вугілля. Навчальний посібник. — Донецьк: Східний видавничий дім, — 2011. — 476 с.