Глікоген

Глікоге́н (також відомий як «тваринний крохмаль», попри неточність цієї назви) — полісахарид, гомополімер α-глюкози, основна форма її зберігання в клітинах тваринних організмів, більшості грибів, багатьох бактерій та архей. У людському організмі головними місцями накопичення глікогену є печінка та скелетні м'язи.
Здатність печінки підвищувати концентрацію глюкози в крові та наявність у ній крохмалеподібної речовини, яку було названо глікогеном, була відкрита в 1875 році Клодом Бернаром[1][2].
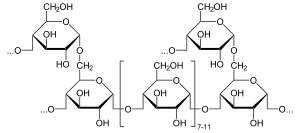
Глікоген є гомополімером α-глюкози, залишки якої з'єднані між собою (α1→4)-глікозидними зв'язками. Кожні 8—10 мономерних залишків відбувається галуження, бічні гілки приєднані (α1→6)-зв'язками. Таким чином молекула глікогену значно більш компактна і розгалужена ніж крохмалю[3]. Ступінь полімеризації близький до такого в амілопектину[4].
Всі розгалуження глікогену мають нередукуючі кінці, отже якщо кількість гілок рівна n, то у молекулі буде n-1 нередукуючих кінців і всього один редукуючий. Коли відбувається гідроліз глікоген з метою використання його як джерела енергії, залишки глюкози по одному відщеплюються від нередукючих кінців. Їх велика кількість дозволяє суттєво прискорити процес[3].
Найстабільнішою конформацією гілок із (α1→4)-зв'язками є щільна спіраль із шістьма залишками глюкози на оберт (площина кожної молекули повернута на 60° відносно попередньої)[5].
Для виконання своєї біологічної функції: забезпечення максимально компактного зберігання глюкози для можливості її швидкої мобілізації, глікоген повинен мати будову оптимізовану за кількома параметрами: 1) кількістю ярусів (рівнів) галуження; 2) кількістю гілок у кожному ярусі; 3) кількістю залишків глюкози у кожній гілці. Для молекули глікогену зі сталим числом мономерних ланок кількість зовнішніх гілок, з яких може мобілізуватись глюкоза до точки галуження, падає зі зростанням середньої довжини кожної гілки. Щільність найбільш зовнішніх гілок стерично обмежена, через це максимальний розмір молекули глікогену зменшується зі збільшенням кількості гілок на одному рівні. Зрілі молекули глікогену різного походження мають в середньому 12 ярусів галуження, на кожному із яких розміщується в середньому по дві гілки, кожна зі яких містить близько 13 залишків глюкози. Математичний аналіз показав, що така будова дуже близька до оптимальної для мобілізації максимальної кількості глюкози за мінімальний час[6].

Глікоген є формою запасання глюкози у тварин[3][4], грибів[7], деяких бактерій (зокрема ціанобактерій[8]) та архей[9]. У мікроорганізмів глікоген більш менш рівномірно розкиданий по цитоплазмі клітини у вигляді гранул діаметром 20—100 нм, їх зазвичай можна побачити тільки через електронний мікроскоп. Якщо клітина містить багато глікогену вона стає червоно-коричневою при зафарбовуванні розчином йоду[10]. У хребетних тварин найбільші кількості глікогену запасаються печінкою, де він може становити 7—10 % загальної маси[11] (100 —120 г у дорослої людини), та скелетними м'язами (1-2 % від загальної маси)[11]. Невеликі кількості глікогену знаходяться в нирках, і ще менші — в певних гліальних клітинах мозку і білих кров'яних тільцях.
Запасання глюкози не у вільній формі, а саме у вигляді полісахаридів диктується двома причинами. По-перше, якби, наприклад, у гепатоциті вся маса глюкози, що входить до складу глікогену, перебувала у вільному стані, її концентрація сягнула би 0,4 моль/л. А це у свою чергу призвело би до значного підвищення осмотичного тиску цитозолю, надмірного надходження води у клітину і її розривання[12]. По-друге, така висока концентрація глюкози зробила би фактично неможливим її активний транспорт з оточення клітини, у випадку гепатоцита із крові, де рівень глюкози становить всього 5 ммоль/л[3]. Зберігання ж глюкози у формі глікогену дозволяє скоротити її концентрацію у клітині до 0,01 мкмоль/л[12].
Запаси глікогену у людей значно менші ніж запаси жирів. Останні мають ряд переваг: по-перше, вони дають можливість отримати більше ніж вдвічі більше енергії ніж така ж маса вуглеводів, по-друге, це гідрофобні молекули і, на відміну від вуглеводів, не потребують гідратації, а це дозволяє скоротити масу енергетичних запасів. Проте глікоген є швидшим джерелом енергії, крім того в організмі тварин відсутні метаболічні шляхи перетворення жирних кислот у глюкозу, а отже вони не можуть використовуватись мозком і в анаеробному метаболізмі м'язів[12].
У гепатоцитах глікоген зберігається у вигляді великих цитоплазматичних гранул. Елементарна так звана β-частинка, що є однією молекулою гілкогену, має діаметр близько 21 нм і включає до 55 000 залишків глюкози та має 2000 нередукуючих кінців. 20—40 таких часточок разом утворюють α-розетки, які можна бачити у під мікроскопом у тканинах тварин, яких добре годують. Проте вони зникають після 24-годинного голодування. Глікогенові гранули — це складні агрегати, до складу яких крім самого глікогену входять ферменти, що синтезують і розщеплюють його, а також регуляторні молекули[12].
Глікоген у м'язах слугує джерелом швидкої енергії як за аеробного, так і за анаеробного метаболізму. Його запаси можуть бути вичерпані за одну годину інтенсивного фізичного навантаження. Регулярне тренування дозволяє збільшити запаси глікогену в м'язах, внаслідок чого вони можуть довше працювати без втоми[13]. У печінці глікоген є резервом глюкози для інших органів, на той випадок, якщо її надходження із їжею обмежене. Особливо важливий такий запас для нейронів, які не можуть використовувати жирні кислоти як енергетичний субстрат. Печінковий запас глікогену під час голодування вичерпується за 12—24 годин[12].
Глікоген також міститься у секреті залоз матки, який вони виділяють в її порожнину у постовуляційний період менструального циклу після запліднення. Тут полісахарид використовуються як джерело живлення для ембріона до його імплантації[13].
Глікоген також надходить в організм із їжею і розщеплюється у тонкій кишці гідролітичними ферментами[12].
Розщеплення глікогену відбувається двома основними шляхами: під час травлення він гідролізується до глюкози, яка може всмоктуватись клітинами епітелію тонкої кишки. Внутрішньоклітинне розщеплення запасів глікогену (глікогеноліз) йде шляхом фосфоролізу, продуктом якого є глюкозо-1-фосфат, цей шлях дозволяє зберегти частину енергії глікозидних зв'язків шляхом формування фосфатного естеру[14]. Таким чином для включення утвореної глюкози у гліколіз або пентозофосфатний шлях не потрібно затрачати АТФ. Крім того утворення глюкозо-1-фосфату є вигідним для м'язів, оскільки для цієї сполуки нема переносників у плазмалемі, і вона не може «втікати» із клітини[15].
У людини перетравлення глікогену (як і крохмалю) починається у ротовій порожнині, де на нього діє α-амілаза слини. Цей фермент гідролізує внутрішньомолекулярні (α1→4)-зв'язки і розщеплює полісахариди до олігосахаридів. У шлунку амілаза слини інактивується через високу кислотність середовища. Шлунковий сік не містить ферментів для перетравлення вуглеводів. У дванадцятипалій кишці на (α1→4)-зв'язки глікогену діє панкреатична α-амілаза, а на (α1→6)-зв'язки — спеціальний дерозгалужуючий фермент аміло-1,6-глікозидаза. Так завершується гідроліз глікогену до мальтози, яка під впливом пристінкового ферменту тонкої кишки мальтази (α-глюкозидази) перетворюється у глюкозу і всмоктується[16].

Внутрішньоклітинний глікоген м'язів та печінки розщеплюється у процесі глікогенолізу, в якому беруть участь три ферменти: глікогенфосфорилаза, глікогендерозгалужуючий фермент та фосфоглюкомутаза[en]. Перший із них каталізує реакцію, в якій неорганічний фосфат атакує глікозидний (α1→4)-зв'язок між двома останніми залишками глюкози із нередукуючого кінця, внаслідок чого відбувається відщеплення останнього залишку у вигляді глюкозо-1-фосфату. Кофактором у цій реакції виступає пірідоксальфосфат[14].
Глікогенфосфорилаза послідовно відщеплює по одному мономеру від нередукуючого кінця поки не досягає місця віддаленого на чотири залишки від (α1→6)-зв'язку (точки галуження). Тут вступає в дію біфункціональний (в еукріот[17]) дерозгалужуючий фермент. Спочатку він каталізує трансферазну реакцію, що полягає у перенесенні блоку із трьох глюкозних залишків із гілки на найближчий нередукуючий кінець, до якого він прикріплюється (α1→4)-зв'язком. Після цього дерозгалужуючий фермент проявляє (α1→6)-глюкозидазну активність, яка полягає у розщепленні (α1→6)-зв'язку і виділенні вільної глюкози[14][15].
Утворений глюкозо-1-фосфат перетворюється фосфоглюкомутазою до глюкозо-6-фосфату, який у скелетних м'язах вступає у процес гліколізу. У печінці глюкозо-6-фосфат також може транспортуватись в ендоплазматичний ретикулум, там підлягати дії глюкозо-6-фосфатази (м'язи позбавлені цього ферменту), перетворюватись у глюкозу і виділятись у кров[14][18].
У незначній мірі біосинтез глікогену (глікогенез) відбувається майже у всіх тканинах організму, проте найбільше він виражений у печінці та м'язах. Цей процес розпочинається із глюкозо-6-фосфату, що утворюється із глюкози в гексокіназній або глюкокіназній реакції. Частина глюкози, що поступає в організм із їжею, спочатку поглинається еритроцитами, які використовують її для отримання енергії у процесі молочнокислого бродіння. Утворений лактат у гепатоцитах перетворюється до глюкозо-6-фосфату в процесі глюконеогенезу[19].
Метаболічні шляхи біосинтезу та розпаду певних сполук зазвичай відрізняються принаймні деякими із реакцій. Метаболізм глікогену був першим відкритим прикладом цього важливого принципу. 1957 року Луїс Лелуар встановив, що в процесі глікогенезу використовується не глюкозо-1-фосфат, а уридиндифосфатглюкоза[20].
Глюкозо-6-фосфат спершу перетворюється до глюкозо-1-фосфат під впливом фосфоглюкомутази. Продукт цієї реакції стає субстратом для ферменту УДФ-глюкозофосфорилази, яка каталізує реакцію:
Оскільки пірофосфат відразу розщеплюється неорганічною пірофосфатазою, то рівновага реакції сильно зміщена в сторону утворення УДФ-глюкози. Остання є субстратом для глікогенсинтази, що переносить залишок глюкози на нередукуючий кінець молекули глікогену[21].
Утворення бічних гілок забезпечує гілкозил-(4→6)-трансглікозилаза (розгалужуючий фермент). Вона відщеплює від гілки, що містить більше 11 мономерних одиниць 6—7 останніх і переносить їх на C6 гідроксильну групу залишку глюкози у більш внутрішньому положенні на тій самій або іншій гілці. Таким чином відбувається галуження, необхідне для кращої розчинності глікогену, та доступу більшої кількості ферментів синтезу та розщеплення до нередукуючих кінців[22].
Глікогенсинтаза може синтезувати глікоген тільки за умови наявності праймера — готового полімеру глюкози із принаймні шістьма мономерними одиницями. Утворення молекул глікогену de novo можливе тільки завдяки білку глікогеніну, що виступає одночасно і «затравкою», на якій збираються нові гілки глікогену і ферментом, що каталізує початок утворення перших із них[22].
Глікогенез та глікогеноліз мають складну систему регулювання на кількох рівнях. Багато із ферментів, що беруть участь у цих процесах є алостеричними і можуть змінювати свою активність пристосовуючись до потреб клітини. Кількість запасів глікогену також регулюється на гормональному рівні для підтримання гомеостазу цілого організму[23].
Порушення обміну глікогену спостерігається при багатьох захворюваннях людини, зокрема при цукровому діабеті. Існує також ряд спадкових розладів, пов'язаних із надмірним відкладанням глікогену в печінці, вони називаються глікогенозами. Зазвичай супроводжуються вираженою гіпоглікемією (зниженим вмістом глюкози в крові) між прийомами їжі. Перший глікогеноз описав у 1929 року Едгар фон Гірке[24], великий внесок у дослідження цих захворювань зробила Герті Корі. Зараз відомо 13 форм глікогенозів, спричинених порушеннями у функціонуванні різних білків[25].
- ↑ Ali H., Anwar M, Ahmad T., Chand N. (2006). Diabetes Mellitus from Antiquity to Present Scenario and Contribution of Greco-Arab Physicians (PDF). JISHIM. 5: 46—50. Архів оригіналу (PDF) за 28 березня 2012. Процитовано 9 липня 2012.
- ↑ Bilous, Rudy W (2010). Handbook of diabetes (вид. 4th). Wiley-Blackwell. с. 5. ISBN 978-1-4051-8409-0.
- ↑ а б в г Nelson et al, 2008, с. 246.
- ↑ а б Voet et al, 2011, с. 370.
- ↑ Nelson et al, 2008, с. 248.
- ↑ Voet et al, 2011, с. 647.
- ↑ Prescott, 2002, с. 557.
- ↑ Prescott, 2002, с. 472.
- ↑ Prescott, 2002, с. 454.
- ↑ Prescott, 2002, с. 51.
- ↑ а б Nelson et al, 2008, с. 594.
- ↑ а б в г д е Nelson et al, 2008, с. 595.
- ↑ а б Marieb, 2006
- ↑ а б в г Nelson et al, 2008, с. 596.
- ↑ а б Berg et al, 2007, с. 594.
- ↑ Березов et al, 1998, с. 320.
- ↑ Berg et al, 2007, с. 595.
- ↑ Berg et al, 2007, с. 596.
- ↑ Nelson et al, 2008, с. 599.
- ↑ Berg et al, 2007, с. 604.
- ↑ Nelson et al, 2008, с. 600.
- ↑ а б Nelson et al, 2008, с. 601.
- ↑ Berg et al, 2007, с. 593.
- ↑ Berg et al, 2007, с. 611.
- ↑ Nelson et al та 2008, 598.
- Berg JM, Tymoczko JL, Stryer L (2007). Biochemistry (вид. 6th). W.H. Freeman and Company. ISBN 0-7167-8724-5.
- Nelson D.L., Cox M.M. (2008). Lehninger Principles of Biochemistry (вид. 5th). W. H. Freeman. ISBN 978-0-7167-7108-1.
- Prescott L.M. (2002). Microbiology (вид. 5th). McGraw−Hill. ISBN 0-07-282905-2.
- Marieb EN, Hoehn K (2006). Human Anatomy & Physiology (вид. 7th). Benjamin Cummings. ISBN 978-0805359091.
- Voet D., Voet J.G. (2011). Biochemistry (вид. 4th). Wiley. с. 487—496. ISBN 978-0470-57095-1.
- Березов Т. Т., Коровкин Б. Ф. (1998). Биологическая химия: Учебник (вид. 3). Москва: Медицина. с. 704. ISBN 5-225-02709-1.
- ГЛІКОГЕН [Архівовано 10 березня 2016 у Wayback Machine.] //Фармацевтична енциклопедія
- ГЛІКОГЕН [Архівовано 11 липня 2020 у Wayback Machine.] //ЕСУ
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
