Гелікази
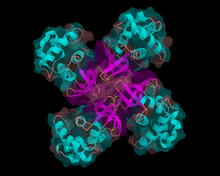
Гелікази (або хелікази, від англ. helix — «спіраль») — клас ферментів, важливих для всіх організмів. Їх відносять до класу «молекулярних машин», оскільки вони використовують енергію гідролізу нуклеотидтрифосфатів (АТФ або ГТФ) для руху уздовж цукрофосфатного остову нуклеїнових кислот (ДНК, РНК, гібридів між ДНК і РНК) і розриву внутрішньо- або міжмолекулярних водневих зв'язків між основами. Виділяють дві великі позасистемні групи — ДНК-гелікази і РНК-гелікази.
Багато процесів життєдіяльності, що відбуваються в клітині, вимагають розділення ланцюгів і розплітання вторинної структури нуклеїнових кислот:
Гелікази розділяють ланцюжки дволанцюгової молекули ДНК або внутрішньомолекулярні зв'язки в молекулах РНК, використовуючи енергію гідролізу АТФ або ГТФ. Вони рухаються уздовж ланцюжка нуклеїнової кислоти в напрямку (5'->3' або 3'->5'), характерному для даного ферменту. У клітині існує декілька десятків геліказ. Геліказам властиві декілька типів структурної організації, вони можуть бути активні як мономер або димер, хоча найкраще вивчені гелікази, наприклад, DNAB активні як гексамер, що утворює бубликоподібну структуру.
- Donmez I, Patel SS. (2006) «Mechanisms of a ring shaped helicase», Nucleic Acids Res. V34(15), pp. 4216-24
- Singleton MR, Dillingham MS, Wigley DB (2007) «Structures and Mechanism of Helicases and Nucleic Acid Translocases», Annu Rev Biochem., V 76
- Vindigni A. (2007) «Biochemical, biophysical, and proteomic approaches to study DNA helicases», Miol. Biosyst, V3(4), pp.266 — 74
| Це незавершена стаття з молекулярної біології. Ви можете допомогти проєкту, виправивши або дописавши її. |